人间充质干细胞成脂分化试剂盒
产品基本信息
产品名称 | Applied Cell® 人间充质干细胞成脂分化试剂盒 |
货 号 | AC-1001029 |
规 格 | 1kit |
保存条件 | 基础培养基2-8℃,添加剂-20--80℃保存; 混合后2-8℃保存,2-3周内使用完毕 |
使用范围 | 人间充质干细胞诱导分化成脂 |
保质期 | 1年 |
产品简介
人间充质干细胞成脂分化试剂盒是埃泽思生物(Applied Cell®)自主研发的一款用于人间充质干细胞分化成脂的试剂盒,可用于骨髓、脐带、脂肪等组织来源的间充质干细胞的成脂分化。本产品仅限于科学研究,不能用于临床诊断、治疗,以及其他用途。
试剂 | 规格 | 数量 | 运输 |
人间充质干细胞成脂分化基础培养基 | 90mL | 1瓶 | 冰袋 |
人间充质干细胞成脂分化添加剂 | 10mL | 1瓶 | 干冰 |
产品内容
产品特性
l 诱导分化程序简单便捷。
l 诱导成脂细胞效率高。
操作方法
1. 相关材料
• Xeno-Free人间充质干细胞培养基(Applied Cell®:AC-1001003)
• 人间充质干细胞成脂分化试剂盒(Applied Cell®:AC-1001029)
• 成脂检测染液(Applied Cell®:AC-1001022)
• Xeno-Free细胞消化液(Applied Cell®:AC-1001024/1001025)
•磷酸盐缓冲液(1×PBS) (Applied Cell®: Cat.AC-1001037)
2.实验准备
人间充质干细胞成脂分化培养基的配制
2.1在2-8℃解冻人间充质干细胞成脂分化添加剂,轻晃摇匀;
2.2 随后将添加剂加入到人间充质干细胞成脂分化基础培养基中(10ml 添加剂与90mL基础培养基彻底混合)混匀,即为人间充质干细胞成脂分化培养基。人间充质干细胞成脂分化培养基可在2-8℃稳定储放2周。
注意:人间充质干细胞脂肪维持添加剂只能在2-8℃解冻,待添加剂加入到培养基以后,请用培养基润洗添加剂瓶1-2次,因添加剂量较少可防止添加剂粘附在试管壁上造成损失。
3. 实验操作
诱导成脂(以6孔板为例)
3.1 将传代或复苏冻存的人间充质干细胞接种到6孔板上,密度为2×105 -3×105 cells/cm2或2×105 -3×105 cells/孔,置于37℃,5% CO2培养箱中培养;
3.2 当人间充质干细胞融合度达到80-90%时,开始诱导脂肪前体细胞分化。吸掉 Xeno-Free人间充质干细胞培养基,每孔加1ml预热PBS清洗一次,吸掉PBS,加入2 ml人间充质干细胞成脂分化培养基,以此记为第0天;
注意:人间充质干细胞成脂分化培养基使用前需预热至37℃。
3.3 每1-2天更换人间充质干细胞成脂分化培养基;
3.4 第5-6天可以看到少量脂滴;
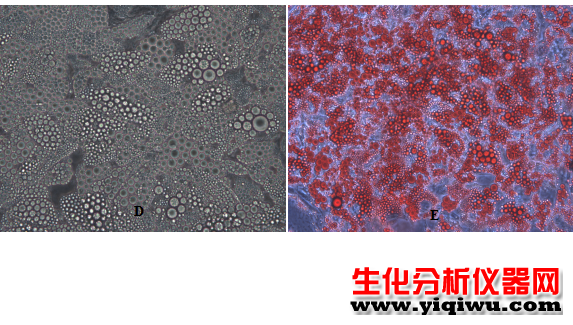
3.5 第9-14天待脂肪滴颗粒成熟即可进行拍照,染色。(根据情况诱导时间可适当延长)
注意:1.培养基每1-2天换液。由于随着脂肪细胞的成熟,pH的降低会观察到培养基变黄。pH从7降到6.5,细胞增殖会变慢。pH在6.5到6时,细胞活力会降低。所以诱导后期,需要每天换液。
2.换液时尽量不使培养基变干,培养基变干会降低细胞层对培养皿表面的粘附。
3.细胞分化效果和供体有关。供体的年龄是一个因素。有研究发现与年长者相比,年轻供体来源的细胞的分化能力更强。



间充质干细胞在成脂分化1天(A)、5天(B)、13天(C)时的细胞照片,可以观察到成簇的脂滴(200×)
4. 成脂检测染液染色
4.1每6ml成脂染液加入4ml蒸馏水制成染色工作液,混匀室温放置5-10分钟。加入蒸馏水后,染液会有片状结晶析出,可用直接使用或滤网过滤除掉结晶。
4.2脂肪诱导分化结束后,吸掉原有培养基,用1×PBS冲洗1-2次。每孔加入适量细胞固定液, 固定20 min。
4.3吸掉细胞固定液,用1×PBS冲洗2次。,加入适量染色工作液,使染液完全覆盖脂肪滴,室温染色15min。
4.4吸掉染色工作液,用1×PBS冲洗2-3次。
4.5将培养板置于显微镜下观察脂滴染色效果,拍照。
注意:染色后显微镜观察,及时拍照。如果时间过长,脂肪滴会发生破裂。
间充质干细胞在成脂后染色前(D)和染色后(E)的照片(400×)